
Tabella dei contenuti
Perché è importante conoscere il tumore nel modo più preciso possibile?
Ogni paziente oncologico è unico. Questo vale non solo per la personalità, ma anche per la malattia. Ogni tumore è diverso. Oggi i medici generano un profilo tumorale completo per caratterizzare il tumore in modo preciso. Perché conoscendo il tumore in modo preciso, vi è la possibilità di trovare una terapia mirata.
La diagnosi di “cancro” è un concetto collettivo per malattie estremamente diverse. Per esempio il tumore alla prostata cresce così lentamente che spesso all’inizio non lo si deve trattare, bensì è possibile aspettare. Altri tipi di tumore invece crescono in modo rapido e aggressivo e, ancora oggi, hanno una prognosi sfavorevole.
Ma anche all’interno di un organo, non tutti i tumori sono uguali. Nel caso del tumore al seno, ad esempio, esistono diversi sottotipi che vengono trattati in modo molto diverso. La categorizzazione del tipo di tumore si basa sulle mutazioni che hanno portato allo sviluppo del tumore; tali mutazioni sono indicate come biomarcatori che possono essere analizzati in modo esatto con un esame. Grazie all’aiuto di questi biomarcatori, viene creato per ogni tumore un profilo tumorale, grazie al quale il trattamento del paziente può essere programmato in modo completamente personalizzato.
Crescita naturale
Il nostro corpo è composto da milioni di cellule. Le cellule sane si moltiplicano dividendosi, come per esempio per la guarigione delle ferite o la crescita dei capelli. Il DNA o i geni di una cellula funzionano da “istruzioni di montaggio” per lo sviluppo della nuova cellula, oltre a regolare il processo di proliferazione cellulare e tutta una serie di segnali che impediscono una crescita troppo scarsa o eccessiva. Se si verificano modifiche nel DNA di una cellula, ciò può avere gravi conseguenze.
Tutto inizia con il dna delle nostre cellule
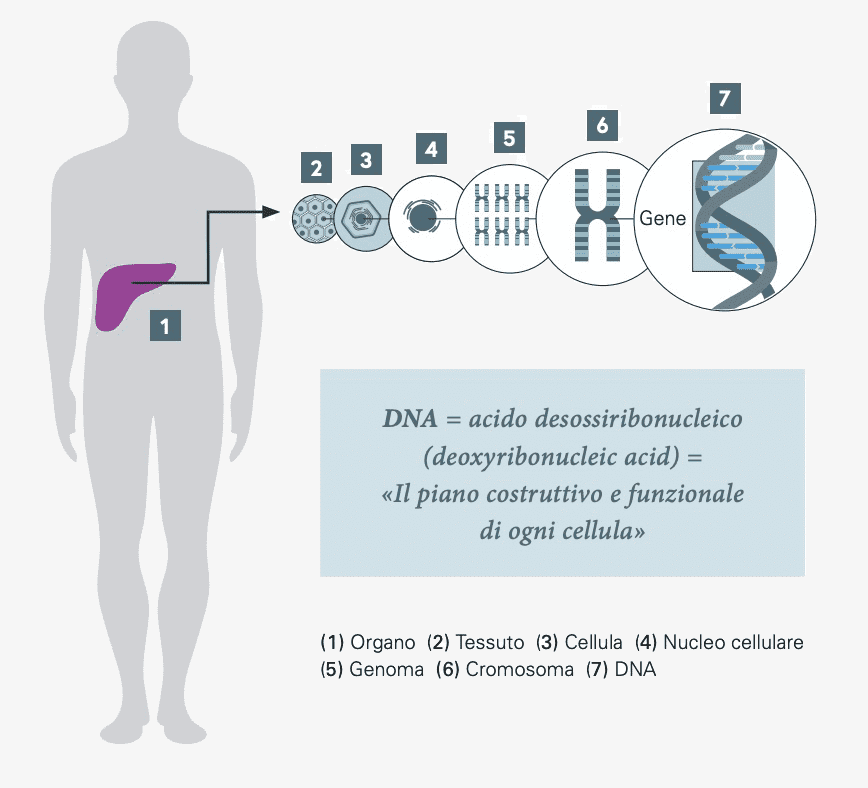
Gli organi del corpo sono costituiti da diversi tessuti che contengono miliardi di cellule. Una cellula è la più piccola unità funzionale del corpo. Ogni cellula ha il proprio nucleo cellulare.
In ogni nucleo cellulare è presente una copia del genoma. Il genoma è l‘insieme di tutte le informazioni ereditarie delle cellule di un essere vivente. Contiene tutti i geni, che a loro volta sono costituiti da filamenti di DNA, il piano costruttivo e funzionale di ogni cellula.
DNA: il vettore delle informazioni genetiche di una cellula (abbreviazione dell’inglese deoxyribonucleic acid).
segmento di DNA che contiene il progetto di uno specifico prodotto genico, ad esempio una proteina
Genoma: indica l’insieme di tutte le informazioni genetiche presenti nella cellula.
Mutazioni geniche come causa del cancro
I tumori non presentano un quadro clinico uniforme, ma si manifestano nelle forme più diverse. Tuttavia, tutti i tumori hanno qualcosa in comune: si basano su cambiamenti, le cosiddette mutazioni, nelle nostre informazioni genetiche, nel DNA e nei geni. All’inizio della malattia, può essere colpita solo una singola cellula del corpo. Ma le mutazioni fanno sì che questa cellula si moltiplichi in modo insolitamente forte, molto più forte delle cellule sane del corpo senza mutazioni. Così può nascere un tumore. Se un tumore di questo tipo non viene scoperto per un certo periodo di tempo, le cellule tumorali possono migrare in altre parti del corpo e formare metastasi.
1) Una lesione al DNA di una cellula può fare trasformare cellule sane in cellule tumorali.
2) Queste possono riprodursi in modo incontrollato fino a dare origine a un tumore.
3) Qualora non ci si accorgesse tempestivamente di questo processo, nel corpo potrebbero svilupparsi metastasi.
Non è raro che si verifichino mutazioni nelle cellule del nostro corpo. Durante la divisione cellulare, ovvero quando l’intera informazione genetica di una cellula viene prima duplicata e poi divisa tra due cellule figlie, si verificano occasionalmente degli errori. Se questi errori si verificano in un gene e il gene viene danneggiato dall’errore, può risultare in una proteina difettosa che non può più svolgere correttamente la sua funzione nella cellula.
Tuttavia, nella maggior parte dei casi, tali mutazioni restano senza conseguenze per la salute. O perché il cambiamento è insignificante o perché è così grave che le cellule figlie non sono in grado di sopravvivere. Può anche accadere che il sistema immunitario riconosca e “smaltisca” la cellula mutata. In rari casi, tuttavia, la cellula mutata sopravvive e viene poi modificata in modo tale da diventare praticamente “immortale” e moltiplicarsi in modo incontrollato. Così si crea un tumore.
Di norma, non è possibile dire come o perché si sia verificata una mutazione. Si sa però che determinati influssi, come per esempio il fumo o la luce solare, aumentano il rischio di mutazioni. Questo perché i cambiamenti genomici si verificano più frequentemente del solito a causa di tali influssi. Talvolta esiste anche una predisposizione genomica congenita a determinati tumori. Tuttavia, questo non significa che la malattia si manifesti sempre, sebbene le persone interessate abbiano un rischio di tumore più alto rispetto alla media della popolazione.
Spesso sono necessarie più mutazioni perché le cellule tumorali inizino a crescere in modo incontrollato. Poiché centinaia di geni diversi sono responsabili della crescita cellulare, innumerevoli mutazioni diverse possono causare il cancro. Oggi molte di queste mutazioni sono state studiate e vengono utilizzate per lo sviluppo di terapie antitumorali, ma molte altre devono ancora essere comprese meglio.
Tumore e sistema immunitario
La formazione di un tumore da cellule mutate dipende essenzialmente dal fatto che il nostro sistema immunitario riconosca queste cellule come una potenziale minaccia e le attacchi.
Come funziona il sistema immunitario
Il sistema immunitario è costituito da diverse cellule immunitarie specializzate. Per poter combattere gli agenti patogeni, le cellule immunitarie devono distinguere tra “conosciuti” e “sconosciuti”. A tal fine, riconoscono determinate proteine presenti sulla superficie dei corpi estranei, note come “antigeni”. In un organismo sano, tali antigeni scatenano una reazione immunitaria che porta alla distruzione degli agenti patogeni. Il sistema immunitario è in grado di proteggere l’organismo non solo da virus o batteri, ma anche dalle sue stesse cellule patologicamente alterate, perché tali cellule hanno sulla superficie antigeni modificati, che le cellule immunitarie identificano ugualmente come “sconosciuti”. Nelle cellule tumorali, le proteine sono indicate come “antigeni tumorali”.
Il processo di riconoscimento del tumore da parte del sistema immunitario, articolato in più fasi, inizia con le cellule tumorali stesse, perché esse liberano gli antigeni tumorali. Alcune cellule del nostro sistema immunitario raccolgono gli antigeni, li trasportano ai linfonodi e lì li presentano alle cellule di difesa diretta dell’organismo, i linfociti T. A questo punto è decisivo che anche i linfociti T riconoscano gli antigeni come pericolosi. Se ciò avviene, i linfociti T si attivano: si moltiplicano e migrano attraverso il flusso sanguigno fino al tumore. Utilizzando gli antigeni tumorali, individuano le cellule tumorali, le attaccano e, nel migliore dei casi, le distruggono. Questa reazione libera nuovamente antigeni tumorali, e questo ciclo positivo, che gli esperti chiamano “ciclo immunocellulare-tumorale” ricomincia da capo. Idealmente, il processo sostenibile avviene naturalmente, in modo che l’organismo possa proteggersi dalle cellule mutate.
1) Krebszellen setzen spezielle Eiweissstoffe frei, sogenannte Krebs-Antigene.
2) Immunzellen greifen Krebs-Antigene auf und tragen sie zu den T-Zellen in den Lymphknoten.
3) Erkennen T-Zellen die Krebs-Antigene als fremd, wir der Krebs bekämpft.
4) Über den Blutkreislauf wandern die T-Zellen zum Tumorgewebe.
5) Die T-Zellen dringen in das Tumorgewebe ein.
6) Sie identifizieren die Krebszellen anhand der Antigene.
7) T-Zellen lösen die Zerstörung der Krebszellen aus. Dadurch werden neue Krebs-Antigene freigesetzt und der Kreislauf beginnt von vorne.
Tuttavia, le cellule tumorali hanno trovato il modo di eludere il sistema immunitario dell’organismo: formano sulla loro superficie cellulare delle proteine che catturano e trattengono i linfociti T. In questo modo i linfociti T non sono più in grado di riconoscere la cellula tumorale come tali e si disattivano. A questo punto le cellule tumorali, ora mimetizzate, possono moltiplicarsi liberamente.
Il legame con la cellula tumorale attraverso una proteina specifica disattiva il linfocita T.
Le cellule tumorali possono produrre diverse proteine che legano i linfociti T inibendo così il sistema immunitario. Ne sono esempi le proteine PD-L1 o CTLA-4. Per determinare il tipo di tumore di un paziente, le cellule tumorali vengono analizzate per queste specifiche proteine che sono associate a tale inibizione del sistema immunitario.
Cosa sono i biomarcatori
Un biomarcatore è una caratteristica biologica specifica che può essere misurata oggettivamente e valutata clinicamente. Serve a indicare se un processo biologico nell’organismo è normale o patologico. I biomarcatori possono essere geni, prodotti genici, proteine od ormoni e fanno quindi parte del profilo tumorale genomico complessivo. Esempi noti di determinazioni di biomarcatori sono la misurazione della pressione sanguigna o dei livelli di zucchero nel sangue. In oncologia vengono spesso usati i biomarcatori genomici, i cosiddetti marker tumorali che indicano da quale mutazione si è sviluppata una cellula tumorale da una cellula sana. Queste mutazioni possono anche influenzare l’aspetto e la consistenza della superficie delle cellule. Il cambiamento può quindi essere analizzato a livello genomico, ma anche a livello molecolare e cellulare.
Come funzionano i test sui biomarcatori
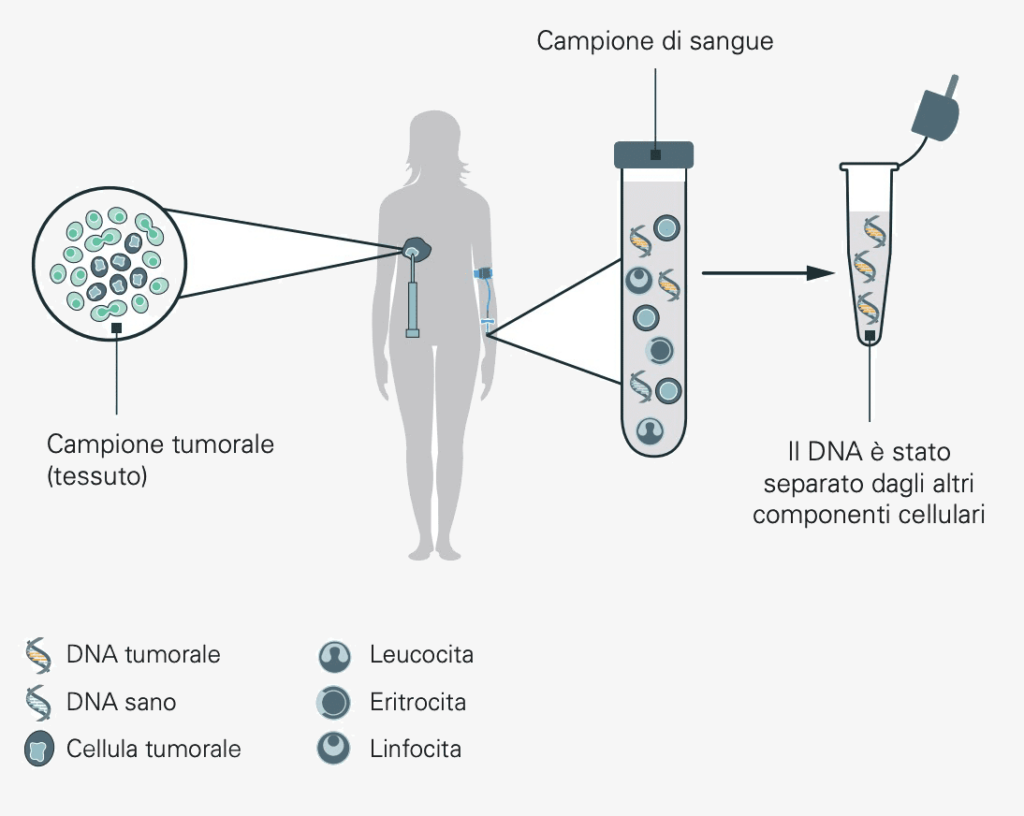
Viene prelevato un campione per esaminare il tumore del paziente.
Questo campione viene analizzato per verificare la presenza di alcuni biomarcatori noti per essere frequentemente alterati nel genoma del rispettivo tipo di tumore. Sulla base del tessuto tumorale, è possibile analizzare precisamente quali sono le alterazioni genetiche.
In determinate condizioni, l’analisi può essere effettuata anche con il sangue, che spesso è più facile da ottenere. Il test basato sul sangue può essere utilizzato se:
- il campione di tessuto tumorale non è più sufficiente per l’analisi;
- il tumore è avanzato e le metastasi sono distribuite nell’organismo;
- il tumore si trova in un punto che rende difficile la biopsia.
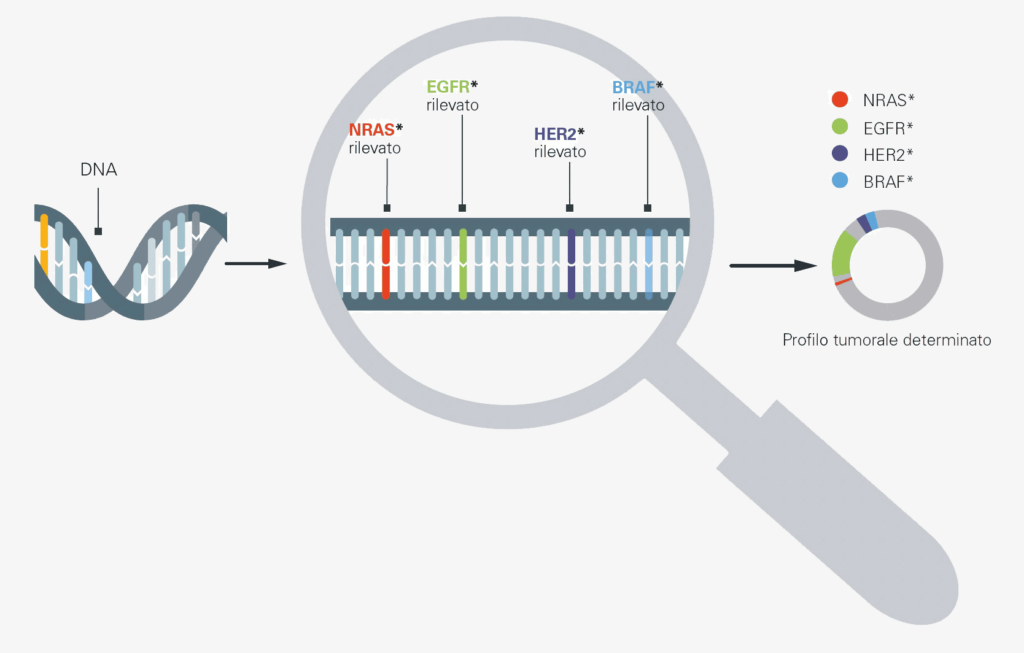
I test sui biomarcatori presentano grandi benefici ai pazienti oncologici. Il concetto di terapia personalizzata utilizza varie alterazioni genetiche come biomarcatori che vengono determinati con l’aiuto di un singolo test sui marcatori o di un profilo tumorale completo, al fine di consentire un controllo più preciso della terapia e un migliore controllo della malattia.
I test a singolo marcatore sono attualmente la variante di test più comune nella diagnostica dei tumori. Consistono in test specifici per una o più alterazioni genetiche predeterminate, tipiche di un particolare tipo di cancro.
Con un’analisi completa del genoma del tumore, il cosiddetto “profilo tumorale completo”, vengono ricercati in un singolo campione di tessuto o di sangue tutti i tipi di cambiamenti genomici in tutti i geni attualmente noti per essere coinvolti nello sviluppo del tumore. In questo modo è possibile identificare cambiamenti che raramente sono associati alla crescita per questo tipo di tumore. Questo apre nuove opzioni di trattamento e potenziali bersagli per il medico, ad esempio se i precedenti trattamenti non hanno avuto successo sul paziente. Quanto più precisamente viene esaminato il tumore, tanto meglio può essere pianificata la terapia i dati sanitari sono la chiave per la terapia personalizzata.
Eseguendo il test, il medico può evitare di utilizzare una terapia inefficace, ad esempio una terapia mirata a una specifica alterazione genomica non presente.
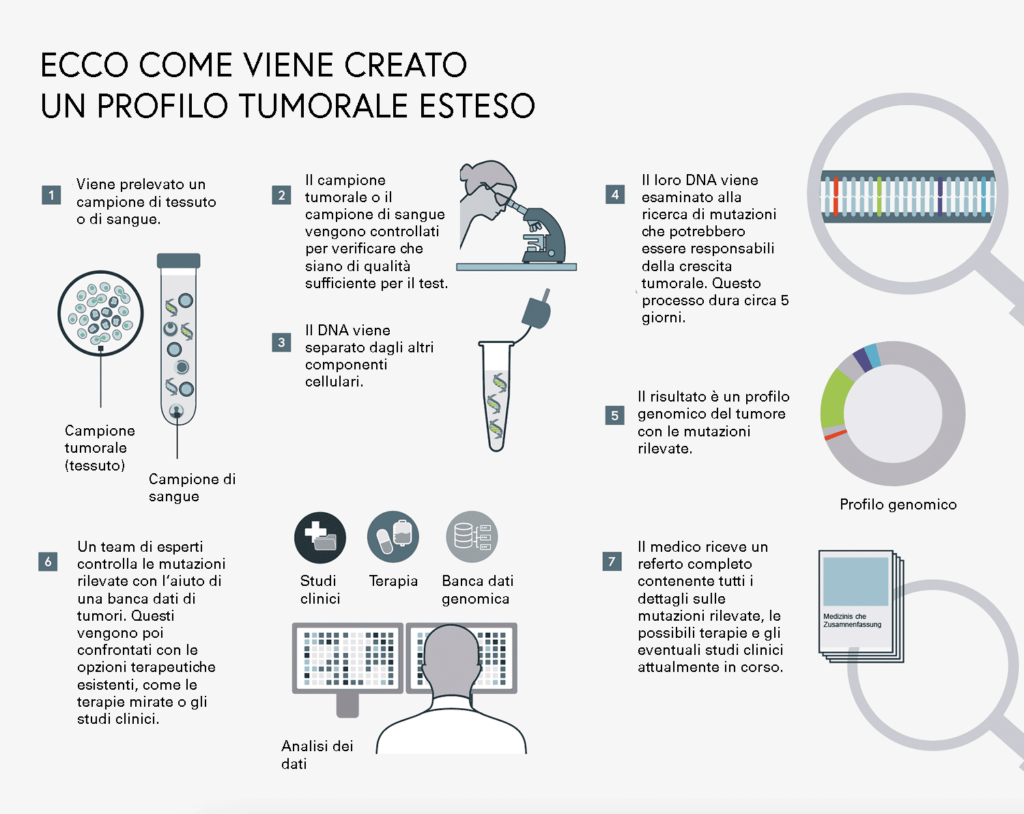
Se il test è positivo, cioè la mutazione ricercata è effettivamente presente, viene utilizzata la terapia sviluppata specificamente per questa mutazione. Il suo effetto mirato inibisce o sopprime idealmente i processi di crescita delle cellule tumorali.
Biomarcatori specifici in diversi tipi di tumore
I test genomici non sono ancora ugualmente avanzati e consolidati per tutti i tipi di tumore. Per alcuni tipi di tumore, come quello al seno e ai polmoni, lo sviluppo è già ben avviato. Per altre tipologie vi è ancora necessità di ricerca e sviluppo.
Esempio: tumore al seno
Sulle cellule sane dei tessuti delle ghiandole mammarie si trovano i recettori ormonali che legano gli ormoni sessuali femminili estrogeno e progesterone. Nel circa 70-80% di tutte le pazienti affette da tumore al seno, le cellule tumorali presentano anche questi recettori. Il tumore viene quindi definito positivo ai recettori ormonali (HR+). Se estrogeno o progesterone si uniscono ai recettori, viene stimolata la proliferazione delle cellule e il tumore subisce una crescita ormono-sensibile. Se le cellule tumorali non presentano recettori, questo tipo di tumore al seno è detto negativo ai recettori ormonali (HR-).
L’HER2 è un recettore che trasmette segnali di crescita dalla superficie della cellula all’interno della cellula. Sulle cellule tumorali può essere presente una quantità eccessiva di HER2, per cui vengono trasmessi troppi segnali e viene stimolata la crescita del tumore. In questi casi si parla di tumore HER2 positivo. Circa il 14% di tutte le pazienti affette da tumore al seno in Svizzera sono HER2 positive.
In circa la metà dei tumori al seno con predisposizione ereditaria, i geni BRCA1 o BRCA2 sono alterati. Questi geni producono proteine che servono a riparare i danni al DNA. Se un gene BRCA è mutato, potrebbe non essere più in grado di svolgere questa funzione e i danni al DNA si accumulano. Questo favorisce lo sviluppo del tumore al seno.
Esempio: tumore al polmone
Nel tipo più comune di tumore polmonare, chiamato carcinoma polmonare non a piccole cellule, molte mutazioni sono già note. Qui sono particolarmente colpiti i geni KRAS, EGFR, ALK e ROS1. Se un tumore presenta un’alterazione in uno di questi geni, può essere trattato in modo mirato con farmaci appropriati. Tuttavia, se non si manifestano tali alterazioni, le terapie mirate sono inefficaci; non è affatto necessario provarle e i pazienti si risparmiano delusioni ed effetti collaterali inutili.
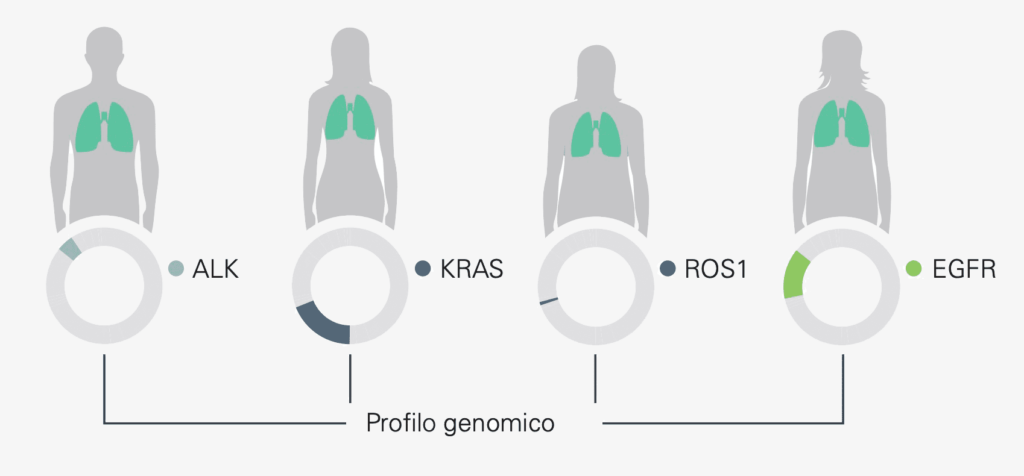
Esempio: biomarcatori rilevanti per diversi tumori
Alcune rare mutazioni genomiche, come per esempio NTRK (recettore neurotrofico della tropomiosina chinasi) e ROS1 (proto-oncogene ROS1) sono presenti in numerosi tumori, tra cui il sarcoma, carcinoma mammario triplo negativo, carcinoma della testa e del collo, delle ghiandole salivari, della vescica e dei polmoni.
Luce di speranza o strada a senso unico?
Anche un profilo tumorale completo non garantisce di trovare una terapia adeguata. In Svizzera non esiste ancora una terapia mirata approvata per alcune alterazioni genomiche che portano a una crescita eccessiva del tumore. Tuttavia, sulla base dei risultati del test è possibile identificare le relative alterazioni genomiche. Ciò può consentire ai pazienti di partecipare a uno studio adeguato in cui vengono testati nuovi farmaci diretti contro questa mutazione.
L’analisi dei biomarcatori cambia la scelta del trattamento oncologico e può consentire una terapia mirata.