
Tabella dei contenuti
Dalla terapia standard alla terapia mirata
Le prospettive per i pazienti sono costantemente migliorate nel corso degli anni. Il tasso di mortalità per cancro è diminuito del 23% dal 1991. Le terapie mirate, in particolare, stanno assumendo un’importanza sempre maggiore: su cinque nuove terapie approvate ogni anno una è mirata. Circa il 50% di queste terapie sono terapie antitumorali.
Come si può trattare un tumore in modo mirato?
Ogni tumore è diverso. Per questo motivo non tutti i tumori possono essere trattati allo stesso modo: ad esempio, due pazienti affette da cancro al seno vengono trattate in modo diverso, proprio in base alle caratteristiche individuali del tumore. Queste terapie mirate consentono una medicina personalizzata, la medicina del futuro.
In passato, il cancro veniva trattato principalmente con la chemioterapia che attacca tutte le cellule dell’organismo che si moltiplicano velocemente. Tuttavia, oltre alle cellule tumorali, ci sono anche le cellule dell’apparato digerente, delle radici dei capelli e del sistema immunitario. Per questo motivo, durante la chemioterapia, i pazienti devono spesso affrontare gravi effetti collaterali come nausea, perdita di capelli e immunodeficienza.
Per una terapia mirata, le informazioni genetiche del tumore vengono prima esaminate in dettaglio. Il farmaco può quindi essere utilizzato per colpire specificamente le caratteristiche del tumore che ne hanno causato lo sviluppo. Sono i suoi punti deboli, perché se vengono eliminati, il tumore non può più crescere in modo incontrollato. Il vantaggio è che si sfruttano le caratteristiche che differenziano il tumore dalle cellule normali del corpo; si possono quindi sviluppare farmaci specifici che inibiscono solo le cellule tumorali e non quelle sane del corpo. La terapia mirata consente così di solito un trattamento meglio tollerato e più efficace rispetto alla terapia oncologica tradizionale.
Cos’è l’immunoterapia oncologica?
Nella maggior parte dei casi, i cambiamenti nelle cellule del nostro corpo vengono riconosciuti dal sistema immunitario e le cellule alterate vengono rapidamente eliminate. Il sistema immunitario dell’organismo può quindi essere un partner importante nella lotta contro il cancro, se può essere attivato in modo mirato.
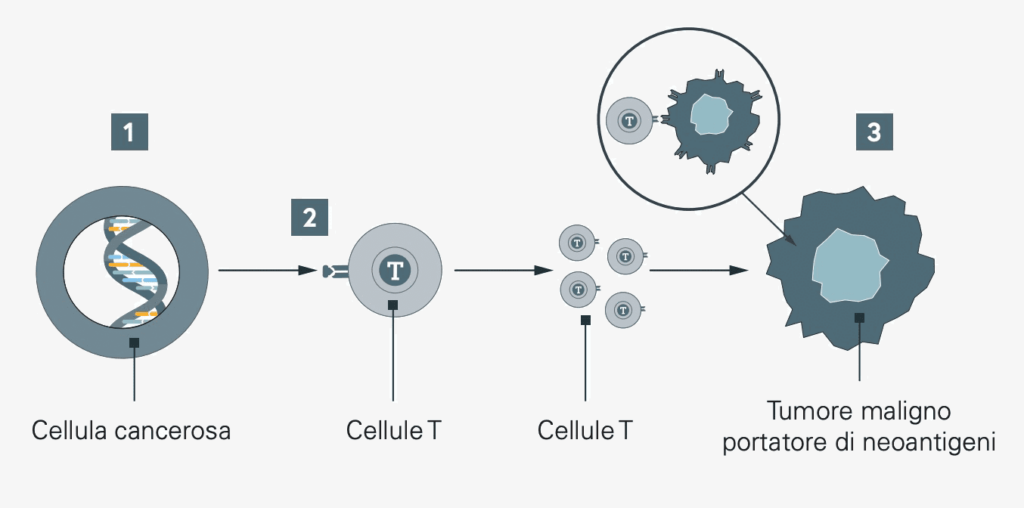
Il nostro sistema immunitario “smaltisce” le cellule tumorali in modo molto efficace. Tuttavia, alcune cellule tumorali hanno trovato il modo di eludere il sistema immunitario dell’organismo: formano speciali proteine sulla loro superficie nascondendosi così dal sistema immunitario. Tuttavia, questo camuffamento può essere eliminato con i farmaci: Se un’analisi precisa delle caratteristiche del tumore rivela la presenza di proteine mimetiche, il tumore può essere reso nuovamente visibile al sistema immunitario con la giusta terapia. È come se si togliesse il freno a mano dal sistema immunitario che riconosce il tumore e lo combatte efficacemente.
Oltre a mimetizzarsi e a nascondersi dal sistema immunitario, le cellule tumorali impediscono al sistema immunitario di reagire. Per farlo, utilizzano i cosiddetti “checkpoint immunitari”: punti di controllo del sistema immunitario in cui la reazione immunitaria può essere annullata. Alcune cellule tumorali sono in grado di attivare questi checkpoint rallentando così la risposta immunitaria. Con l’uso dei cosiddetti inibitori dei checkpoint, i checkpoint del sistema immunitario attivati dalle cellule tumorali vengono saltati e il sistema immunitario è mantenuto attivo. Le cellule immunitarie dell’organismo possono nuovamente riconoscere e combattere le cellule tumorali.

Alcuni tumori tendono maggiormente alle mutazioni rispetto ad altri: si modificano più frequentemente e quindi presentano più mutazioni nel corso del tempo. Questa caratteristica del tumore è misurata come carico mutazionale del tumore (TMB, dall’inglese Tumor Mutational Burden). Un valore elevato di TMB è spesso associato positivamente alla risposta all’immunoterapia oncologica. Questo perché ogni cambiamento rende la cellula tumorale più diversa da una cellula normale, facilitando il riconoscimento da parte del sistema immunitario.
Domande frequenti sull’immunoterapia oncologica
Quando vengono utilizzate le immunoterapie?
A oggi, l’immunoterapia con inibitori dei checkpoint è stata utilizzata principalmente negli stadi avanzati di varie patologie tumorali. La ricerca sta facendo progressi, tanto che queste opzioni terapeutiche vengono occasionalmente utilizzate anche negli stadi più precoci.
Come viene somministrata l’immunoterapia oncologica?
La somministrazione avviene tramite infusione e pertanto è somministrata da un medico o in una clinica. Di solito si tratta di un trattamento ambulatoriale, il che significa che non è necessario un ricovero ospedaliero di più giorni.
Come verifica il medico se la terapia funziona?
Nell’ambito del trattamento con l’immunoterapia oncologica, vengono eseguiti a intervalli regolari esami di diagnostica per immagini (TC o RM). Questo mostrerà se la terapia sta funzionando. Buono a sapersi: il sistema immunitario a volte ha bisogno di un po’ di tempo per fare il suo lavoro. Può quindi accadere che l’effetto sia ritardato. È qui che è necessaria l’esperienza del medico.
Quali effetti collaterali possono verificarsi con l’immunoterapia oncologica?
L’immunoterapia oncologica è solitamente ben tollerata. Tuttavia, bisogna fare attenzione a non stimolare eccessivamente il sistema immunitario. Altrimenti, in alcune circostanze, può colpire anche le cellule sane; questo evento è detto “reazione autoimmune”. Gli effetti collaterali più comuni sono facilmente controllabili. Stanchezza, esantema, febbre, perdita di appetito o nausea sono tra questi. Informazioni dettagliate e assistenza in caso di effetti collaterali possono essere richieste al medico curante.
Terapie mirate in vari tipi di tumore
Se si conoscono esattamente le caratteristiche del tumore, è possibile trattarlo in modo più specifico. Il tumore viene quindi esaminato in dettaglio e analizzato per diversi biomarcatori prima dell’inizio del trattamento. A seconda delle caratteristiche del tumore, la terapia viene adattata e personalizzata.
Esempio: tumore al seno
Nel tumore al seno si distinguono tre tipi di tumore: nella maggior parte dei casi, le cellule del tumore al seno sono più sensibili agli ormoni sessuali femminili, come gli estrogeni o il progesterone, rispetto alle cellule normali. In questo caso, le terapie anti-ormonali spesso funzionano bene. In circa una paziente su sette, tuttavia, il tumore al seno non dipende dagli ormoni sessuali, ma da un recettore chiamato HER2 che trasmette i segnali di crescita nell’organismo e può essere facilmente inibito con i farmaci. Se nessuna delle tre caratteristiche (dipendenza da estrogeni, progesterone e HER2) è presente nel tumore, si parla di tumore al seno (o carcinoma mammario) triplo negativo. In tal caso, spesso non è possibile effettuare terapie specifiche, per cui si procede al trattamento con la classica chemioterapia.
I geni BRCA1 e BRCA2 sono i fattori scatenanti più comuni delle forme ereditarie di tumore al seno. Se un gene BRCA è mutato, il danno al DNA può non essere più riparato con la stessa efficienza e può accumularsi. Questo favorisce lo sviluppo del tumore al seno. Ma se le cellule tumorali hanno troppi danni nel loro DNA, muoiono. Per questo motivo altri sistemi di riparazione del DNA, come il sistema PARP, sono fondamentali per la sopravvivenza delle cellule tumorali. I PARP-inibitori sfruttano questo principio attivo inibendo il meccanismo di riparazione nelle cellule tumorali. Per le donne con una mutazione BRCA accertata, il trattamento con un PARP-inibitore può quindi essere un’opzione.
Esempio: tumore al polmone
Nel tipo più comune di tumore al polmone, noto come carcinoma polmonare non a piccole cellule, esistono già molte terapie mirate contro singole alterazioni, tra cui quelle nei geni chiamati KRAS, EGFR, ALK e ROS1. Una diagnostica completa con analisi genomiche del tumore è quindi particolarmente importante in questo caso. Se è presente una delle alterazioni, il tumore può essere trattato con i farmaci appropriati. Ma anche se non viene trovata nessuna di queste mutazioni, si tratta d’informazioni preziose per la pianificazione della terapia: grazie a esse si possono evitare terapie inefficaci fin dall’inizio.
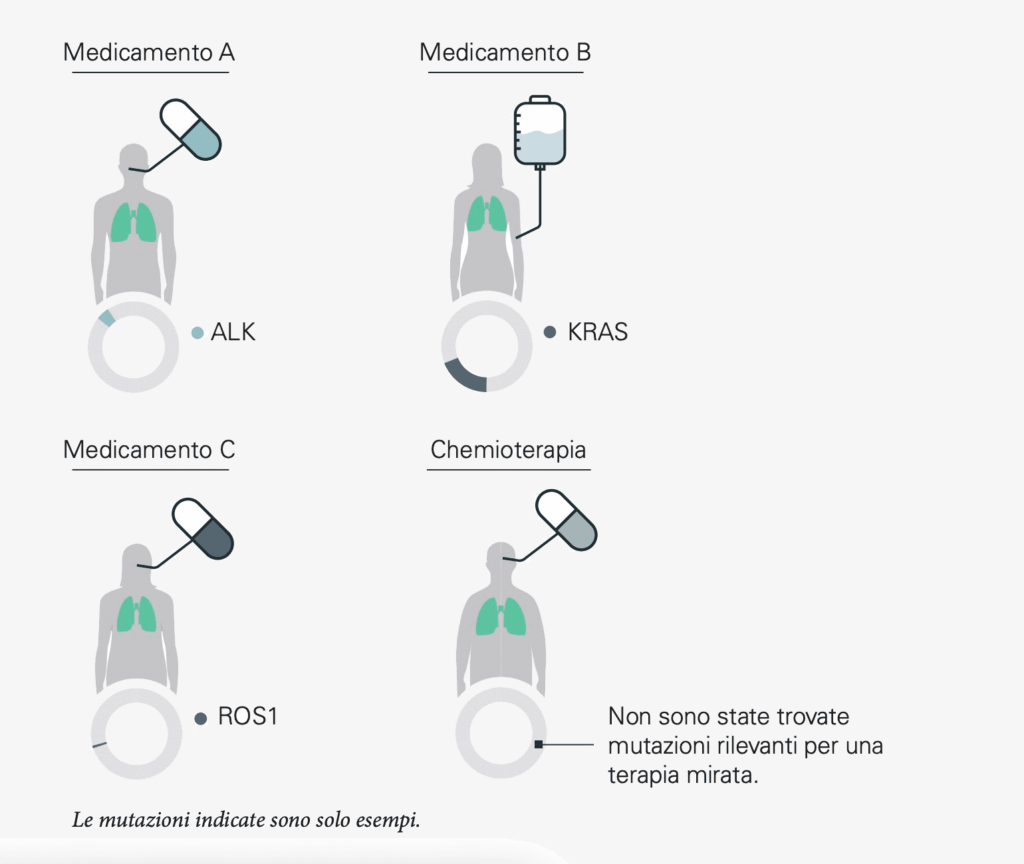
L’EGFR è un “sito di innesto” per le sostanze messaggere sulla superficie cellulare, un cosiddetto recettore. Se una sostanza messaggera si aggancia all’EGFR alterato, la cellula riceve un segnale di divisione amplificato. La mutazione del gene provoca quindi una crescita incontrollata delle cellule tumorali. Esistono farmaci che bloccano l’EGFR impedendo così alla cellula tumorale di ricevere segnali di crescita. La crescita incontrollata viene frenata. Questi principi attivi sono chiamati “inibitori della tirosin-chinasi dell’EGFR”. Ne è un esempio il cosiddetto gene EGFR che presenta alterazioni genomiche nel 10-15% di tutti i pazienti affetti da carcinoma polmonare non a piccole cellule.
ALK è una particolare forma di mutazione genica nota come “fusione genica” in cui il gene ALK si fonde con un altro gene e viene definito “fusione genica di ALK”. In seguito a essa, il gene è permanentemente attivo e porta alla crescita incontrollata delle cellule tumorali. I cosiddetti “inibitori di ALK” sono utilizzati come farmaci mirati.
Le mutazioni genetiche del gene ROS1 sono molto rare. Anch’esse fanno sì che le cellule tumorali ricevano più segnali di crescita e si dividano in modo incontrollato. Fanno sì che le cellule tumorali ricevano un aumento dei segnali di crescita e si dividano in modo incontrollato. Anche per il tumore al polmone ROS1-positivo sono disponibili terapie mirate.
Esempio: terapie mirate a livello tumorale
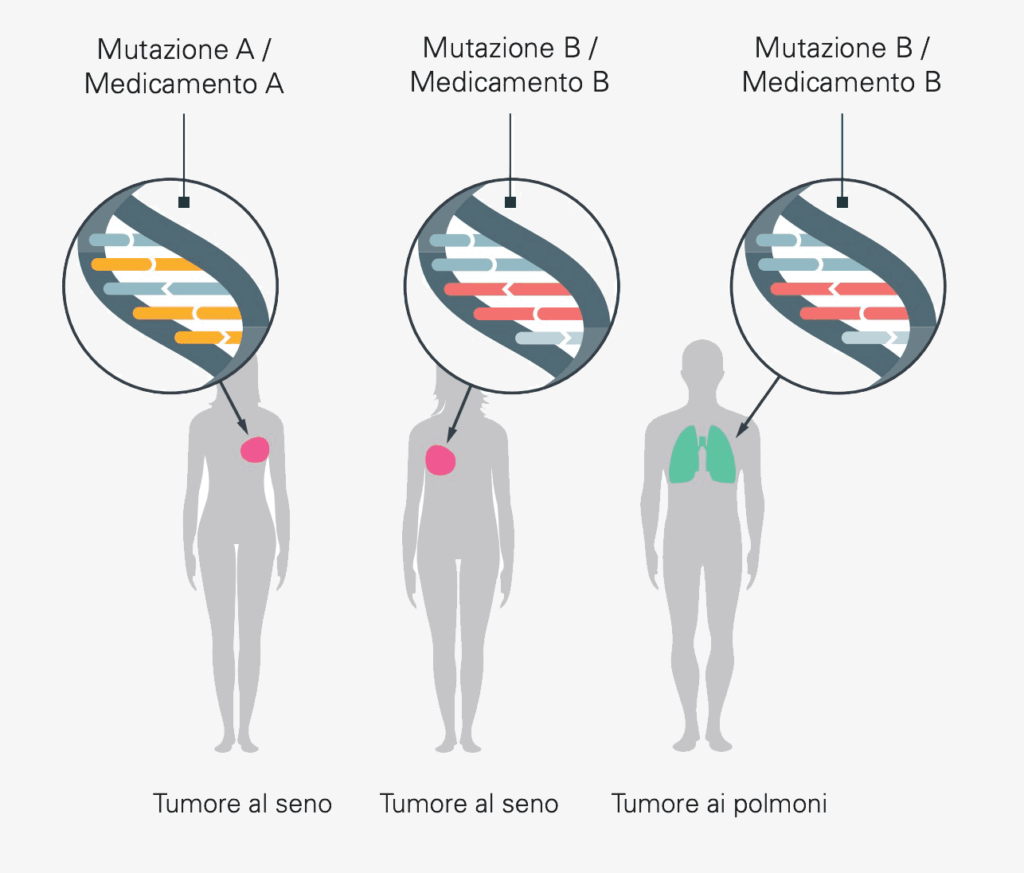
I progressi della ricerca medica consentono una comprensione sempre più approfondita delle malattie tumorali e di come esse siano causate da alterazioni del patrimonio genetico del tumore. È ormai noto che due soggetti con quello che sembra essere la stessa malattia oncologica (ad esempio il tumore al seno) possono avere mutazioni completamente diverse nel loro DNA e devono quindi essere trattati in modo diverso. D’altra parte, due soggetti il cui tumore è localizzato in organi diversi possono avere le stesse mutazioni. Entrambi potrebbero quindi beneficiare di una terapia simile.
Esempi di biomarcatori non specifici per il tumore sono rare alterazioni genomiche come per esempio NTRK e ROS1, importanti tra l’altro nel sarcoma, nel tumore al seno triplo negativo, nel carcinoma della testa e del collo, delle ghiandole salivari, della vescica e dei polmoni.
Lo sviluppo continua
Gli studi indicano che un trattamento basato sul profilo genomico del tumore può portare a un migliore risultato terapeutico in molti tipi di tumore. Per questo si stanno svolgendo molte ricerche in questo settore. Ciò aumenta la nostra comprensione delle mutazioni nel cancro e consente di sviluppare costantemente nuove terapie oncologiche mirate. L’obiettivo è quello di poter offrire al maggior numero possibile di pazienti trattamenti particolarmente ben tollerati ed efficaci.
Riepilogo
La terapia mirata è specificamente diretta contro le caratteristiche del tumore e supporta il sistema immunitario nel combattere nuovamente il tumore. Quanto più precisamente si conosce un tumore, tanto meglio lo si può trattare in modo mirato.